Lewis Diagrams Made Easy: How to Draw Lewis Dot Structures
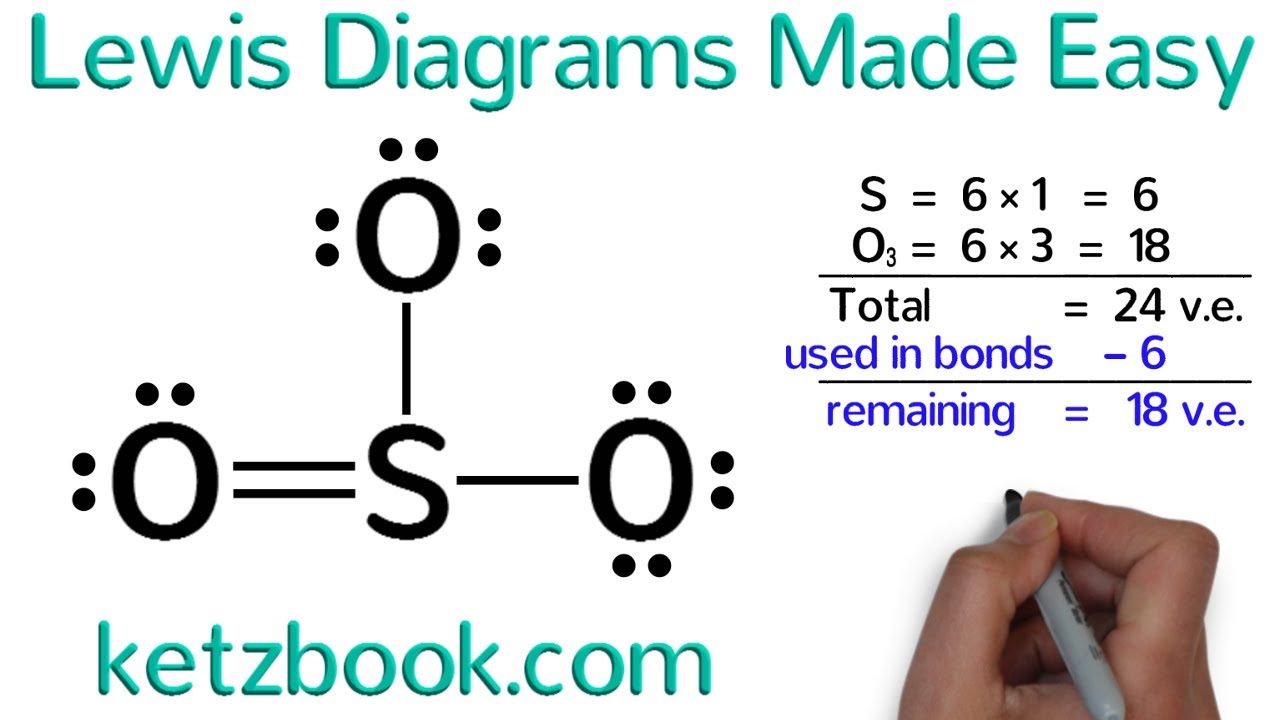
Bienvenido a Diagramas de Lewis "Fácil" con Ketzbook Hoy vamos a aprender a dibujar diagramas de Lewis para átomos y moléculas simples, pero antes de comenzar, comencemos con una pregunta. ¿Cuántos electrones de valencia tiene el cloro? Para responder a esa pregunta, necesitamospara mirar la Tabla Periódica. Recuerde que dentro de cualquier columna dada, todos los elementos tienen el mismo número de electrones de valencia. Para obtener ese número, todo lo que hacemos es contar lascolumnas comenzando desde la izquierda. Omita los metales de transición, y recuerde que la única excepción a esto es el helio, que tiene solo 2 electrones de valencia, no 8. Ahora, encuentre el cloro en la Tabla Periódica. Recuerde que su símbolo es Cl. Lo ve en la columna 7? Eso nos dice que tiene 7 electrones de valencia. Conocer el número de electrones de valencia que tiene un elemento es crítico, y en los diagramas de Lewis, usamos puntos para representar electrones de valencia. Entonces, el diagrama de Lewis de cloro es: el símbolo Cl con 7 puntos a su alrededor. Cuando dibujes los puntos, no los pongas en cualquier lado. En cambio, imagina un cuadrado alrededor del símbolo del elemento. Los puntos deben dibujarse cuidadosamente en los cuatrolados del cuadrado con no más de dos puntos en cualquiera de los lados Practica dibujando los diagramas de Lewis de unos pocoselementos solo para asegurarte de que lo tienes. Este es el diagrama de Lewis de hidrógeno, quetiene solo un electrón de valencia Este es el carbono, que tiene cuatro electrones de valencia,y esto es oxígeno, que tiene 6 electrones de valencia. No importa donde colocas los puntos realmente siempre y cuando los dibujes a lo largo del los lados de un cuadrado imaginario y nunca se ponemás de dos puntos en un lado. Los diagramas de Lewis se usan a menudo para representarenlace covalente e ionico en moléculas. En la unión covalente, los átomos comparten electrones de valenciapara obtener un octeto completo o dúo, todo elemento no metálico quiere 8 electrones de valencia, a excepción del hidrógeno, que solo quiere dos electrones de valencia. La molécula más simple posible es la dehidrógeno, H2. Un átomo de hidrógeno tiene un electrón de valencia,pero quiere tener dos. Entonces, para satisfacer su deseo de otroelectrón, dos átomos de hidrógeno compartirán sus electrones entre sí. Y lo loco es que en el maravillosomundo de los átomos, los electrones compartidos se cuentan como poseídos por ambos átomos. Eso significa que ambos átomos de hidrógeno son felicesporque ambos satisfacen la regla del octeto. Ahora, normalmente dibujamos hidrógeno y otras moléculasasí con líneas para representar electrones compartidos y puntos solo para electrones que no se unen. Estos dos diagramas de una molécula de hidrógeno son equivalentes porque una línea, que es un enlace simple, representa 2 electrones compartidos. Del mismo modo, dos líneas entre átomos serían un doble enlace y sería el intercambio de 4 electrones. Un ejemplo de una molécula con un doble enlacees oxígeno, que se ve así. Tenga en cuenta que en este diagrama de Lewis ambos átomos de oxígeno tienen 8 electrones de valencia, 4 del doble enlace y 4 de los pares de electrones solitarios. Por cierto, 2 puntos juntos se llaman par de electrones solitarios. Algunas moléculas contienen triples enlaces, queescribimos usando 3 líneas que representan el intercambio de 6 electrones. Un ejemplo de una molécula con un enlace triplees nitrógeno, que se ve así. Una vez más, observe que ambos átomos de nitrógenotienen 8 electrones de valencia, 6 del triple enlace y 2 de los pares de electrones solitarios . Ok, ¿cómo dibujas el diagrama de Lewis de una molécula? Comencemos con agua, H2O. Hay 5 pasos importantes que necesitas seguir para dibujar el diagrama de Lewis de una molécula Primero, cuente todos los electrones de valenciaen la molécula Para el agua, cada hidrógeno tiene un electróny multiplicamos eso por dos porque hay dos hidrógenos en la molécula. El oxígeno tiene 6 electrones de valencia. Suma todos, y tenemos un total de 8electrones de valencia para la molécula de agua. Paso 2, determina el átomo central. El átomo central es al que todos losotros átomos estarán unido. Por lo general, es el elemento que presenta uno solo. En el caso de H2O, porque hay 2 hidrógenosy solo un oxígeno, elegimos oxígeno como el átomo central y se escribe en el medio. Paso 3, dibuja enlaces simples al átomo central. Paso 4, coloca todos los electrones de valencia restantesen átomos como pares solitarios. Para H2O, comenzamos con 8 electrones de valencia;hemos usado cuatro electrones para los dos enlaces simples por lo que deja 4 electrones más a la izquierda. Ponemos los 4 electrones restantesen oxígeno en lugar de hidrógeno porque el hidrógeno ya está contento con 2 electrones de valencia. Recuerde, nunca le dé al hidrógeno más de 2 electrones de valencia. Todos los demás quieren 8 electrones, pero el hidrógenosolo quiere 2. Paso 5, convierte pares solitarios en dobles o triplesenlaces para dar a cada átomo un octeto o (dúo para hidrógeno). Pausa el video y mira si todos los átomos ennuestras H2O son felices Porque cada hidrógeno tiene 2 electrones, yel oxígeno tiene 8 electrones, todos están felices, y no hay necesidad de doble o tripleenlace, lo que significa que nuestro diagrama de Lewis de agua ahora está completo. Muy bien, probemos un ejemplo más solopara asegurarnos de que tenemos esto. Dibuja el diagrama de Lewis del trióxido de azufre. Una vez más, el primer paso es contar todoslos electrones de valencia. Hay un azufre con seis electrones de valencia,y hay 3 oxígenos con 6 electrones de valencia cada uno 6 veces 3 nos da 18 electrones de valencias paralos 3 oxígenos. El total sería 6 + 18, lo que equivale a 24electrones de valencia. Paso 2, determina el átomo central. Esta vez, el azufre es el átomo central porquesolo hay un azufre en la molécula Escribimos azufre en el medio con los tresátomos de oxígeno a su alrededor. Paso 3, dibuja enlaces simples al átomo central. Paso 4, comenzamos con 24 electrones de valencia,y hemos usado 6 electrones para hacer los 3 enlaces simples. Esto significa que tenemos 24 menos 6 o 18 electrones de valencia restantes. Ahora ponemos los 18 electrones de valencia restantesen átomos como pares solitarios. Cuente por dos al agregarlos. 2, 4, 6, 8, 10, 12, 14, 16 y 18. Eso es todo, hemos agotado todos nuestroselectrones de valencia. Paso 5, primero pausa el video y verificamira si algún átomo no tiene un octeto o dúo. Así es, el azufre no está contento porquesolo tiene 6 electrones de valencia. Entonces, ¿qué podemos hacer para que sea feliz? No podemos simplemente darle más electrones, ya queno tenemos más En cambio, uno de los átomos de oxígeno puede tomaruno de sus pares solitarios y compartir esos dos electrones con azufre en otro enlace. El doble enlace entre oxígeno y azufreahora hace feliz a cada átomo con 8 electrones de valencia. Asegúrese de seguir estos pasos cuando dibuje el Diagramas de Lewis. Gracias por ver. Comenta, vota, suscribe o revisame fuera en ketzbook.com.